Secuenciación genética en pacientes pediátricos
Secuenciar el ADN de recién nacidos con anomalías congénitas (AC) y niños que presentan retraso del desarrollo (RD) o discapacidad intelectual (DI) ayuda a identificar la causa genética de dichas anomalías y a mejorar el manejo y cuidado de dichos pacientes a largo plazo.
Copyright © 2012 University of Washington (www.mcri.edu.au)
Cuando llega a la consulta un paciente que presenta alguna anomalía congénita o retraso intelectual o del desarrollo, el clínico o el asesor genético puede indicar la realización de un test genético.
La heterogeneidad que existe actualmente en el abordaje de estos casos en los hospitales hace que varíen los tiempos en que se tarda en alcanzar el diagnóstico y el momento de intervenir.
Test genéticos convencionales o de primera línea:
Microarray –> estudio de los cromosomas del paciente. Alteraciones cromosómicas como el síndrome de deleción 22q11 pueden ser las responsables de una DI de origen desconocido.
Panel de genes –> selección de los genes que se van a estudiar según los síntomas que presenta el paciente. Esta selección incluye solo los genes en que se sospecha que puede haber alteraciones por lo que, si no se encuentra ninguna alteración genética se deben plantear estudios o test alternativos para intentar identificar la causa.
La segunda línea de actuación conlleva la utilización de nuevas técnicas de secuenciación masiva que permiten analizar en muy poco tiempo gran cantidad de genes de forma simultánea, por tanto, aportan mucha más información y aumentan la tasa diagnóstica.
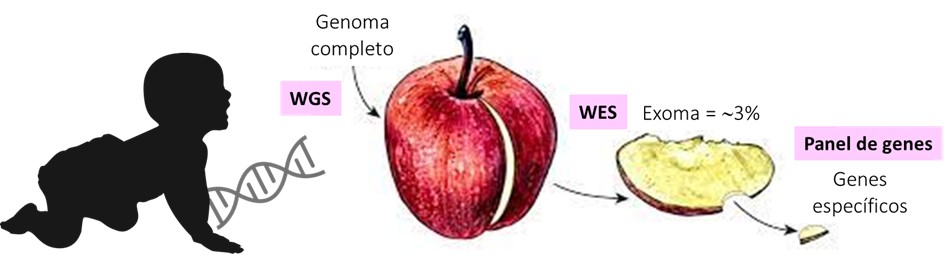
– Secuenciación de exoma completo del inglés Whole Exome Sequencing (WES) –> analiza todos los exones o partes codificantes de los genes. Son regiones donde se producen mutaciones con mayor frecuencia. La limitación de esta técnica es que quedan regiones de ADN sin analizar.
– Secuenciación de genoma completo del inglés Whole Genome Sequencing (WGS) –> analiza todo el ADN. El mayor inconveniente de esta técnica es que al secuenciar TODO el genoma, analizar e interpretar la información es una tarea más compleja y además, la probabilidad de encontrar variantes genéticas de significado incierto es mayor.
A la hora de optar por estas técnicas de secuenciación es interesante analizar de forma simultánea a otro familiar directo (padre/madre/hijos) para aumenta la tasa de éxito y detectar de forma más sencilla variantes raras en esa familia. Estos son los llamados análisis “dúo” o “trío”
La secuenciación completa del genoma humano ofrece ventajas que debemos aprovechar para mejorar el pronóstico y calidad de vida de estos pacientes.

- 01 – Permite aumentar la tasa diagnóstica de pacientes pediátricos con estas patologías
- El diagnóstico molecular de una enfermedad rara permite:
Encontrar asociaciones de pacientes y redes de apoyo
Pautar un manejo adecuado y prevenir complicaciones
Beneficiarse de ensayos clínicos y tratamientos innovadores
Obtener un pronóstico más certero
Tomar decisiones reproductivas y/o de planificación familiar
- El diagnóstico molecular de una enfermedad rara permite:
- 02 – Ayuda a entender la historia y evolución de muchas enfermedades, ya que pueden identificarse nuevos genes y/o rutas afectados.
- 03 – Abre la puerta a encontrar nuevos tratamientos
- Estrategias como la terapia génica pueden prevenir el desarrollo de graves secuelas reestableciendo el defecto genético causante de la patología.
- 04 – Acorta la odisea diagnóstica
- No es necesario derivar a los pacientes de un especialista a otro o de un hospital a otro, se reduce la angustia de los padres y la ansiedad que implica el no tener una causa por lo que ya no recurrirán a internet u otros profesionales no adecuados en busca de respuestas. Además, acelerar los diagnósticos permite cambiar el manejo del paciente a corto plazo, lo cual tendrá un impacto positivo en su calidad de vida a largo plazo.
- La odisea diagnóstica: Pacientes con enfermedades raras esperan 4 años para recibir un diagnóstico
- El Estudio de Necesidades Sociosanitarias de las personas con Enfermedades Raras en España (Estudio ENSERio) impulsado por FEDER en 2009 y su actualización en 2016-2017 ha conseguido una muestra representativa de 11 de las 17 Comunidades Autónomas a partir de la cual se han extrapolado conclusiones a nivel nacional sobre la realidad que viven estos pacientes y sus familiares. En dicho estudio se ha visto que casi la mitad de los encuestados han sufrido retraso en su diagnóstico (49,68%); de ellos, un 18,65% tardaron más de 10 años, y un porcentaje similar (el 18,08%) entre 4 y 9 años.
- La demora diagnóstica puede conllevar el agravamiento de los síntomas de la enfermedad al no recibir un tratamiento o que este no sea el adecuado; así como la necesidad de atención psicológica para afrontar las consecuencias emocionales de esa situación. El estudio demostró que en España dicha demora es menor en aquellas Comunidades Autónomas con centros asistenciales de más alto nivel (que coinciden con poblaciones mayores) y, por tanto, de mayores recursos tanto materiales como humanos para poder hacer frente a diagnósticos poco comunes.
- 05 – Reduce los costes sanitarios
- Con un único test tenemos toda la información, así se evitan pruebas innecesarias. Los diagnósticos tempranos permiten además tratar cuanto antes cada patología y hacerlo de manera individualizada y precisa evitando los costes generados al administrar múltiples medicamentos y/o al paliar los efectos adversos derivados de un tratamiento inadecuado.
- 06 – Constituye una apuesta de futuro
- Aún falta por conocer el significado de muchas variantes por lo que si reanalizamos de forma periódica la información genética almacenada se podrá confirmar o descartar la patogenicidad de esas variantes sin recurrir a otras pruebas.




Mejorar el abordaje de pacientes pediátricos con anomalías congénitas o trastornos intelectuales o del desarrollo pasa por implementar el uso de WES/WGS como primera línea de actuación en la práctica clínica.
Manickam, K., McClain, M.R., Demmer, L.A. et al.Exome and genome sequencing for pediatric patients with congenital anomalies or intellectual disability: an evidence-based clinical guideline of the American College of Medical Genetics and Genomics (ACMG). Genet Med (July 2021). https://doi.org/10.1038/s41436-021-01242-6
*Si quieres conocer qué son los hallazgos incidentales, qué tipo de hallazgos se pueden encontrar, cómo se debe informar de su presencia y las estrategias para abordarlos… ¡No te pierdas la próxima entrada del Blog!